Definisi
Leukemia adalah suatu
keadaan keganasan sel darah putih yang dapat terjadi pada umur, jenis kelamin
dan ras apa saja bergantung pada jenis leukemianya. Sedangkan Leukemia mieloblastik akut (LMA) atau
leukemia mieloid akut disebut juga leukemia mielositik akut adalah suatu penyakit yang ditandai dengan transformasi
neoplastik dan gangguan diferensiasi sel-sel progenitor dari sel myeloid yang
berlangsung dalam waktu yang relatif cepat. Bila tidak diobati, penyakit ini akan
mengakibatkan kematian secara cepat dalam waktu beberapa minggu sampai bulan
sesudah diagnosis.
Secara epidemiologi, di negara
maju seperti Amerika Serikat, LMA merupakan 32% dari seluruh kasus leukemia. Insidens
leukemia mieloblastik akut (LMA) kira-kira 2-3/100.000 penduduk. LMA lebih
sering ditemukan pada umur dewasa (85%) daripada anak-anak (15%). Insidens LMA umumnya tidak berbeda dari masa anak-anak
hingga masa dewasa muda. Sesudah usia 30 tahun, insidensi LMA meningkat secara
eksponensial sejalan dengan meningkatnya usia. LMA pada orang yang berusia 30
tahun adalah 0,8%, pada orang yang berusia 50 tahun 2,7%, sedang pada orang
yang berusia di atas 65 tahun adalah sebesar 13,7%. Secara tidak umum tidak
didapatkan adanya variasi antar etnik tentang insidensi LMA, meskipun pernah
dilaporkan adanya insidens LMA tipa M3 yang 2,9 hingga 5,8 kali besar pada ras
Hispanik yang tinggal di Amerika Serikat dibandingkan dengan ras Kaukasia. Ditemukan
lebih sering pada laki-laki daripada wanita. LMA dapat ditemukan sekitar 40%
dari seluruh insidens leukemia.
Sebelum tahun 1960an
pengobatan LMA terutama bersifat paliatif (hanya meningkatkan kualitas hidup
bukan menyembuhkan), tetapi sejak sekitar 40 tahun yang lalu pengobatan
penyakit ini berkembang secara cepat dan dewasa ini banyak pasien LMA yang dapat
memperbesar kemungkinan penyembuhan dari penyakitnya. Kemajuan pengobatan LMA
ini dicapai dengan regimen kemoterapi yang lebih baik, kemoterapi dosis tinggi
dengan dukungan cangkok sumsum tulang dan terapi suportif yang lcbih baik
seperti antibiotik generasi baru dan transfusi komponen darah untuk mengatasi
efek samping pengobatan. Selain itu sejak sekitar 2 dekade tahun yang lain juga
telah dikembangkan teknik diagnostik leukemia dengan cara immunophenotyping dan
analisis sitogenetik yang menghasilkan diagnosis yang lebih akurat.
Klasifikasi
Menurut perjalanan
penyakitnya, leukemia dapat dibagi atas leukemia akut dan kronik. Dengan
kemajuan pengobatan akhir-akhir ini, pasien leukemia limfoblastik akut dapat hidup lebih lama daripada pasien leukemia granulositik kronik. Dengan
demikian pembagian akut dan kronik tidak lagi mencerminkan lamanya harapan
hidup. Namun pembagian ini masih menggambarkan kecepatan timbulnya gejala dan
komplikasi.
Menurut jenisnya, leukemia
dapat dibagi atas leukemia mieloid dan limfoid. Masing-masing ada yang akut dan
kronik. Secara garis besar, pembagian leukemia adalah sebagai berikut:
a.
Leukemia mieloid
- Leukemia granulositik kronik (leukemia mieloid / mielositik / mielogenous kronik)
- Leukemia mieloblastik akut (leukemia mieloid / mielositik / granulositik / mielogenous akut)
b.
Leukemia limfoid
- Leukemia limfositik kronik.
- Leukemia limfoblastik akut.
Menurut klasifikasi FAB
(French-American-British), LMA dibagi menjadi :
- M0 : Differensiasi leukemia minimal
- M1 : Mieloblastik, tanpa maturasi, 90% blast, peroksidase (+) , Granula azurofil, kadang batang Auer (+)
- M2 : Mieloblastik, dengan maturasi , 50% sel tdd mieloblast dan premieloosit, Maturasi di luar promielosit (+)
- M3 : Promielositik hipergranular Sebagian besar sel tdd promielosit abnormal, peroksidase (+)
- M4 : Mielomonositik, 20% monosit, 20% mieloblast dan promielosit
- M5 : Monositik, berdiferensiasi/tidak berdiferensiasi, < 20% granulosit
- M6 : Erythroleukemia, 50% sel adalah sel eritroid abnominal atau 30% mieloblast & promielosit, Kadang batang Auer (+)
- M7 : Megakaryoblastic leukemia
Klasifikasi WHO Untuk
LMA
|
I. LMA
dengan translokasi sitogenetik rekuren :
II. LMA
dengan multilineage dysplasia dengan sindrom myelodisplasia tanpa sindrom
myelodisplasia
III. LMA
dan sindrom myelodisplastik yang berkaitan dengan terapi akibat obat alkilasi
akibat epipodofilotoksin (beberapa merupakan kelainan limpfoid) tipe lain
IV. LMA
yang tidak terspesifikasi :
|
Etiologi
Etiologi LMA secara pasti tidak diketahui. Meskipun demikian, ada beberapa faktor
yang diketahui dapat menyebabkan atau setidaknya menjadi faktor predisposisi
LMA pada populasi tertentu. Benzene merupakan zat leukomogenik untuk LMA.
Selain itu, radiasi ionik juga diketahui dapat menyebabkan LMA. Terdapat
penelitian pada orang-orang yang selamat dari serangan bom atom Hiroshima dan
Nagasaki pada tahun 1945. Efek leukomogenik dari paparan ion radiasi tersebut
mulai tampak sejak 1.5tahun sesudah pengeboman dan mencapai puncak 6 atau 7
tahun sesudah pengeboman.
Faktor lain yang merupakan predisposisi untuk LMA adalah trisomi kromosom
21 yang dijumpai pada penyakit herediter sindrom Down. Pasien sindrom Down
mempunyai risiko 10 hingga 18 kali lebih tinggi untuk menderita leukemia,
khususnya LMA tipe M7. Selain itu pasien beberapa sindrom genetik seperti
sindrom Bloom dan anemia Fanconi juga diketahui mempunyai risiko yang jauh
lebih tinggi dibandingkan populasi normal untuk menderita LMA.
Faktor lain yang memicu terjadinya LMA adalah pengobatan dengan kemoterapi sitotoksik pada pasien tumor padat. LMA akibat
terapi adalah komplikasi jangka panjang yang serius dari pengobatan limfoma,
mieloma multipel, kanker payudara, kanker ovarium dan kanker testis. Jenis
kemoterapi yang paling sering memicu timbulnya LMA adalah golongan alkalyting agent dan topoisomerase II inhobitor. LMA akibat
terapi mempunyai prognosis yang lebih buruk dibandingkan LMA de novo sehingga
di dalam klasifikasi leukemia versi WHO dikelompokkan tersendiri.
Etiological factors
in acute leukaemia
|
|
Unknown (usually)
|
|
Hereditary
|
·
Down’s syndrome
·
Bloom’s syndrome
·
Fanconi’s anaemia
·
Ataxia telangiectasia
·
Kleinfelter’s syndrome
·
Osteogenesis imperfecta
·
Wiskott-Aldrich syndrome
·
Leukaemia in siblings
|
Chemicals
|
·
Chronic benzene exposure
·
Alkylating agents (chlorambucil, melphalan)
|
Radiation
|
|
Predisposing haematological diseases
|
·
myeloproliferative disorders
·
myelodysplasia
·
aplastic anaemia
|
Viruses
|
HTLV-I
causing adult T cell leukaemia/lymphoma
|
( Diambil dari: T
Everington, R J Liesner, A H Goldstone. Acute Leucemia. Ed:Provan D. Clinical
Haematology. Second edition. BMJ books. 2003. P:30)
Patogenesis
Patogenesis utama LMA
adalah adanya blokade maturitas yang menyebabkan proses diferensiasi sel-sel
seri mieloid terhenti pada sel-sel muda (blast) dengan akibat terjadi akumulasi
blast di sumsum tulang . Akumulasi blast di dalam sumsum tulang akan
menyebabkan gangguan hematopoesis normal dan pada gilirannya akan mengakibatkan
sindrom kegagalan sumsum tulang (bone marrow failure syndrome) yang ditandai
dengan adanya sitopenia (anemia, lekopenia dan trombositopenia). Adanya anemia
akan menyebabkan pasien mudah lelah dan pada kasus yang lebih berat sesak nafas,
adanya trombositopenia akan menyebabkan tanda-tanda perdarahan, sedang adanya
leukopenia akan menyebabkan pasien rentan terhadap infeksi, termasuk infeksi
oportunis dari flora bakteri normal yang ada di dalam tubuh manusia. Selain itu
sel-sel blast yang terbentuk juga punya kemampuan untuk migrasi keluar sumsum
tulang dan berinfiltrasi ke organ-organ lain seperti kulit, tulang, jaringan
lunak dan sistem syaraf pusat dan merusak organ-organ tersebut dengan segala
akibatnya.
Manifestasi
Klinis
Gejala
a.
Kelemahan Badan dan Malaise
Merupakan keluhan yang sangat sering
diketemukan oleh pasien, rata-rata mengeluhkan keadaan ini sudah berlangsung
dalam beberapa bulan. Sekitar 90 % mengeluhkan kelemahan badan dan malaise
waktu pertama kali ke dokter. Rata-rata didapati keluhan ini timbul beberapa
bulan sebelum simptom lain atau diagnosa LMA dapat ditegakkan. Gejala ini
disebabkan anemia, sehingga beratnya gejala kelemahan badan ini sebanding
dengan anemia.
b.
Febris
Febris
merupakan keluhan pertama bagi 15-20 % penderita. Seterusnya febris juga
didapatkan pada 75 % penderita yang pasti mengidap LMA. Umumnya demam ini
timbul karena infeksi bakteri akibat granulositopenia atau netropenia. Pada
waktu febris juga didapatkan gejala keringat malam, pusing, mual dan
tanda-tanda infeksi lain.
c.
Fenomena perdarahan
Simptom
lain yang sering disebabkan adalah fenomena perdarahan, dimana penderita
mengeluh sering mudah gusi berdarah, lebam, petechiae, epitaksis, purpura dan
lain-lain. Beratnya keluhan perdarahan berhubungan erat dengan beratnya
trombositopenia.
d.
Penurunan berat badan
Penurunan
berat badan didapatkan pada 50 % penderita tetapi penurunan berat badan ini
tidak begitu hebat dan jarang merupakan keluhan utama.
Penurunan
berat badan juga sering bersama-sama gejala anoreksia akibat malaise atau
kelemahan badan.
e.
Nyeri tulang
Nyeri
tulang dan sendi didapatkan pada 20 % penderita LMA. Rasa nyeri ini disebabkan
oleh infiltrasi sel-sel leukemik dalam jaringan tulang atau sendi yang
mengakibatkan terjadi infark tulang.
Tanda
Fisik
a. Kepucatan,
takikardi, murmur
Pada pemeriksaan fisik, simptom yang
jelas dilihat pada penderita adalah pucat karena adanya anemia. Pada keadaan
anemia yang berat, bisa didapatkan tanda cardiorespiratorius seperti sesak
nafas, takikardia, palpitasi, murmur, sinkope dan angina.
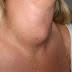
b. Pembesaran
organ-organ
Walaupuan jarang didapatkan dibandingkan
LLA, pembesaran massa abnomen atau limfonodi bisa terjadi akibat infiltrasi
sel-sel leukemik pada penderita LMA. Splenomegali lebih sering didapatkan
daripada hepatomegali. Hepatomegali jarang memberikan gejala begitu juga
splenomegali kecuali jika terjadi infark.
c. Kelainan
kulit dan hipertrofi gusi
Deposit sel leukemik pada kulit sering
terjadi pada subtipe LMA tertentu, misalnya leukemia monoblastik (FAB M5)
dan leukemia mielomonosit (FAB M4). Kelainan kulit yang didapatkan
berbentuk lesi kulit, warna ros atau populer ungu, multiple dan general, dan
biasanya dalam jumlah sedikit. Hipertrofi ini akibat infiltrasi sel-sel
leukemia dan bisa dilihat pada 15 % penderita varian MSa, 50 % MSa dan 50 % M4.
Namun hanya didapatkan sekitar 5 % pada subtipe LMA yang lain.
d. Sternal
tenderness
Kelainan fisik ini didapatkan pada
kira-kira dua per tiga kasus LMA. Kelainan ini juga disebabkan infiltrasi
sel-sel leukemik, terutama di tempat produksi sumsum tulang
Pemeriksaan
Laboratorium
Kelainan Laboratium
a. Angka
Leukosit
Pada umumnya, angak leukosit meningkat
pada sebagian besar penderita LMA, tetapi angka leukosit juga bisa normal atau
turun. Didapati angka leukosit bervariasi antara kurang dari 1000 hingga
100.000 per mm3.
Pada angka leukosit normal atau turun,
ini dinamakan sub leukemik leukemia, dimana masih dapat ditemukan sel blast
dalam darah tepi.
b. Sel
Blast darah tepi
Sel blast meningkat dalam darah tepi
pada penderita LMA. Jumlah sel blast dapat bervariasi dari nol hingga 200 x 109
/ 1 median antara 15 – 20 x 109/1.
Pada umumnya, ada korelasi antara jumlah
sel blast dalam darah dan sumsum tulang dengan pembesaran lien atau manifestasi
infiltasi sel leukemik lain.
Bilamana didapati tiada sel blast dalam
darah tepi dinamakan aleukemik leukemia. Keadaan ini bisa ditemukan ± 5%
penderita LMA.
c. Angka
trombosit
Trombositopenia sebagai akibat
infiltrasi sumsum tulang oleh sel-sel leukemia ditemukan pada kebanyakan
penderita. Pada keadaan yang sangat jarang ada ditemukan trombositosis.
d. Sel
eritrosit
Anemia normositik normokromik ditemukan
pada sebagian besar penderita LMA. Dalam apusan darah tepi juga didapatkan
eritrosit bernukleus serta retikulositopenia. Anemia terjadi sebagai akibat
gangguan produksi sel dalam sumsum tulang yang diakibatkan oleh infiltrasi
sel-sel leukemia pada sumsum tulang.
e. Sumsum
tulang
Biasanya sumsum tulang dalam keadaan
hiperseluler, dimana kepadatan sel-sel meningkat. Pada pemeriksaan mikroskopik
sel-sel blat (mieloblast) dominan, jumlah megakariosit dan sel-sel normoblast
sangat menurun. Bila dilakukan biopsi dan pengecatan retikulum akan didapatkan
myelofibrosis ini dapat diperhatikan pada dua per tiga kasus LMA.
f. Asam
urat darah
Pada kira-kira separuh kasus LMA, dapat
ditemukan asam urat darah meningkat dan begitu juga pada ekskresi asam urat
dalam urin, tetapi jarang menimbulkan simptom gout.
g. Protein
darah
Protein darah biasanya berubah. Hiper
gamma globulin yang difus didapatkan pada kebanyakan penderita, sedangkan
albumin selalu normal waktu diagnosis dan menurut bila lanjut. Beta globulin
biasanya naik dan umumnya kenaikkan alfa globulin didapatkan pada keadaan demam
atau infeksi. Protein pengikat vitamin B12 bisa meningkat dalam
darah pada penderita LMA khususnya bila ditemukan leukositosis. Protein
pengikat asam folat meningkat bagi beberapa penderita, terutama pada leukemia
mielomonoblastik.
 |
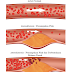
| Gambaran preparat darah apus tepi Leukemia Mieloblastik Akut |
Pada LMA tidak selalu dijumpai leukositosis. Leukositosis terjadi
pada sekitar 50% kasus LMA, sedang 15% pasien mempunyai angka leukosit yang
normal dan sekitar 35% pasien mengalami neutropenia. Meskipun demikian, sel-sel blast dalam jumlah yang signifikan di darah tepi akan ditemukan
pada 85% kasus LMA. Oleh karena itu sangat penting untuk memeriksa rincian
jenis sel-sel leukosit di darah tepi sebagai pemeriksaan awal, untuk menghindari
kesalahan diagnosis pada orang yang diduga menderita LMA.
Tanda dan gejala utama LMA adalah adanya rasa lelah, perdarahan dan infeksi
yang disebabkan oleh sindrom kegagalan sumsum tulang sebagaimana disebutkan di
atas. Perdarahan biasanya terjadi adalam bentuk purpura atau petekia yang
sering dijumpai di ekstremitas bawah atau berupa epistaksis, perdarahan gusi
dan retina. Perdarahan yang lebih berat jarang terjadi kecuali pada kasus yang
disertai dengan DIC. Kasus DIC ini paling sering dijumpai di tenggorokan,
paru-paru, kulit dan daerah perirektal, sehingga organ-organ tersebut harus
diperiksa secara teliti pada pasien LMA dengan demam.
Pada pasien dengan angka leukosit yang sangat tinggi (>100 ribu/mm3),
sering terjadi leukostasis, yaitu terjadinya gumpalan leukosit yang menyumbat
aliran pembuluh darah vena maupun arteri. Gejala leukostasis, yaitu terjadinya
gumpalan leukosit yang menyumbat aliran pembuluh darah vena maupun arteri.
Gejala leukostasis sangat bervariasi, tergantung lokasi sumbatannya. Gejala
yang sering dijumpai adalah gangguan kesadaran, sesak nafas, nyeri dada dan
priapismus. Angka leukosit yang sangat tinggi juga sering menimbulkan gangguan
metabolisme berupa hiperurisemia dan hipoglikemia. Hiperurisemia terjadi akibat
sel-sel leukosit yang berproliferasi secara cepat dalam jumlah yang besar.
Hipoglikemia terjadi karena konsumsi gula in
vitro dari sampel darah yang akan diperiksa, sehingga akan dijumpai
hipoglikemia yang asimptomatik karena hipoglikemia tersebut hanya terjadi in vitro
tetapi tidak in vivo pada tubuh
pasien.
Infiltrasi sel-sel blast akan
menyebabkan tanda/gejala yang bervariasi tergantung organ yang di infiltrasi.
Infiltrasi sel-sel blast di kulit
akan menyebabkan leukemia kutis yaitu berupa benjolan yang tidak berpigmen dan
tanpa rasa sakit, sedang infiltrasi sel-sel blast
di jaringan lunak akan menyebabkan nodul di bawah kulit (lkoroma).
Infiltrasi sel-sel blast ke dalam
gusi. Meskipun jarang, pada LMA juga dapat dijumpai infiltrasi sel-sel blast ke daerah menings dan untuk
penegakan diagnosis diperlukan pemeriksaan sitologi dari cairan serebro spinal
yang diambil melalui prosedur pungsi lumbal.
Penatalaksanaan
Terapi LMA
direncanakan untuk tujuan kuratif. Penderita yang mempunyai
peluang besar untuk mencapai tujuan kuratif adalah mereka
yang berusia <60 tahun, tanpa komorbiditas yang berat serta mempunyai profil
sitogenik yang favorable. Untuk
mendapatkan hasil pengobatan yang maksimal, sangat penting untuk melakukan skrining
awal dengan teliti sebelum pengobatan dimulai. Skrining awal ini, terutama
ditujukan untuk mendeteksi kemungkinan adanya infeksi, gangguan fungsi jantung
(regimen terapi standar LMA mengandungi preparat golongan antrasiklin yang
bersifat kardiotoksik) dan adanya koagulopati yang sering ditemukan pada
penderita LMA. Selain itu, penderita yang mempunyai angka leukosit pra-terapi
yang sangat tinggi (>100 ribu/mm3), mungkin memerlukan tindakan leukoparesis
emergensi untuk menghindari leukostasis dan sindrom tumor lisis akibat terapi induksi, sangat
penting untuk mengingatkan agar terapi LMA sebaiknya dilakukan di rumah sakit
yang mempunyai tim leukemia yang bersifat multi-disiplin, sarana laboratorium
mikrobiologi yang memadai, akses untuk transfusi darah yang lengkap serta ruang
steril/semi-steril untuk pelaksanaan pengobatan. Tanpa prasarana tersebut angka
kematian saat pengobatan akan sangat tinggi.
Untuk mencapai
hasil pengobatan yang kuratif harus dilakukan eradikasi sel-sel klonal leukemik dan
memulihkan hematopoesis normal di dalam sumsum tulang. Survival jangka panjang hanya didapatkan pada pasien yang mencapai
remisi komplit. Dosis kemoterapi tidak perlu diturunkan karena alasan adanya
sitopenia, karena dosis yang diturunkan ini tetap akan menimbulkan efek samping
berat berupa supresi sumsum tulang, tanpa punya efek yang cukup untuk
mengeradikasi sel-sel leukemik maupun untuk mengembalikan fungsi sumsum tulang.
Eradikasi
sel-sel leukemik yang maksimal, memerlukan strategi pengobatan yang baik. Umumnya
regimen kemoterapi untuk pasien LMA terdiri dari dua fase: fase induksi dan
fase konsolidasi. Kemoterapi fase induksi adalah regimen kemoterapi yang
intensif bertujuan untuk mengeradikasikan sel-sel leukemik secara maksimal
sehingga tercapai remisi komplit. Istilah remisi komplit digunakan bila jumlah
sel-sel darah di peredaran darah tepi kembali normal serta pulihnya populasi
sel di sumsum tulang termasuk tercapainya jumlah sel-sel blast <5%. Perlu ditekankan disini, meskipun terjadi remisi
komplit tidak berarti sel-sel klonal leukemik telah tereradikasi seluruhnya,
karena sel-sel leukemik akan terdeteksi secara klinik bila jumlahnya lebih dari
109 log sel. Jadi pada kasus remisi komplit, masih tersisa sejumlah signifikan
sel-sel leukemik di dalam tubuh pasien tetapi tidak dapat dideteksi. Bila
dibiarkan, sel-sel ini berpotensi menyebabkan kekambuhan di masa-masa yang akan
datang. Oleh karena itu, meskipun pasien telah mencapai remisi komplit perlu
ditindak lanjuti dengan program pengobatan selanjutnya yaitu kemoterapi
konsolidasi. Kemoterapi konsolidasi biasanya terdiri dari beberapa siklus
kemoterapi dan menggunakan obat dengan jenis dan dosis yang sama atau lebih
besar dari dosis yang digunakan pada fase induksi. Pengobatan eradikasi sel-sel
tumor ini sebenarnya dapat menyebabkan eradikasi sisa-sisa sel hematopoiesis
normal yang ada di dalam sumsum tulang, sehingga pasien LMA akan mengalami
periode apalsia pasca terapi induksi. Pada saat tersebut pasien sangat rentan
terhadap infeksi dan perdarahan. Pada kasus yang berat kedua komplikasi ini
dapat berakibat fatal. Oleh karena itu terapi suportif berupa penggunaan
antibiotika dan transfusi komponen darah (khususnya sel darah merah dan
trombosit) sangat penting untuk menunjang keberhasilan terapi LMA.
Terapi LMA dibedakan menjadi 2 yaitu terapi untuk LMA pada umumnya dan
terapi khusus untuk leukemia promielositik akut (LPA).
Terapi LMA pada Umumnya
Terapi standar
7+3 adalah kemoterapi induksi dengan regimen sitarabin dan daunorubisin dengan
protokol sitarabin 100mg/m2 diberikan secara infus kontinyu selama 7 hari dan
daunorubisin 45-60 mg/m2/hari iv selama 3 hari. Sekitar 30-40% pasien mengalami
remisi komplit dengan terapi sitarabin dan daunorubisin yang diberikan sebagai
obat tunggal, sedang bila diberikan sebagai kombinasi remisi komplit dicapai
oleh lebih dari 60% pasien. Bila terdapat residual
disease pada hari ke-28 perlu dipertimbangkan adanya gagal terapi primer
dan perlu dimulai terapi alternatif dengan regimen lain.
Pada pasien
dengan gangguan fungsi jantung pemakaian antrasiklin merupakan kontra indikasi
terutama bila terdapat riwayat miokard infark dan fraksi ejeksi kurang dari
50%. Pilihan terapi pada kondisi ini adalah high dose cytarabine (ara-C)/HDAC. Regimen
terapi yang dipakai pada HDAC adalah sitarabin 2-3 g/m2 infus iv selama 1-2 jam
tiap 12 jam selama 12 dosis atau sitarabin 2-3 g/m2 selama 2 jam setiap 12 jam
pada hari 1,3 dan 5.
Pilihan untuk
terapi post remisi dapat berupa kemoterapi konsolidasi, transplantasi sel stem
hematopoetik (hematopoetic stem cell
transplantion/HSCT) otolog, atau HSCT alogenik. Jenis terapi pada pasca
remisi ditentukan berdasarkan usia dan faktor prognostik, terutama profil
sitogenetik. Sebagian besar pasien usia muda memberikan respons yang lebih baik
dibanding pasien usia tua.
Bila terjadi
relaps dapat diberikan lagi kemoterapi intensif dan/atau HSCT untuk mencapai
remisi komplit kedua atau hanya diberikan perawatan suportif. Pencapaian remisi
komplit kedua tidak begitu dipengaruhi karakter sitegenetik, namun lebih
dipengaruhi oleh durasi remisi komplit pertama, usia, dan ada tidaknya
komorbiditas aktif. Durasi median remisi komplit kedua umumnya kurang dari 6
bulan bila tanpa HSCT dengan disease-free
survival kurang dari 10 bulan. Survival meningkat bila sebelumnya pasien
telah menjalani HSCT alogenik, namun donor untuk prosedur tersebut umumnya
terbatas.
Terapi Leukemia Promielositik
Akut
Insidensi LPA (Leukosit
Promielositik Akut) sebesar 10-15%
pasien LMA. Penyakit ini ditandai dengan kelainan sitogenetik berupa t (15,17)
yang dijumpai pada sekitar 90% kasus. Kelainan sitogenetik t (15;17) akan
menyebabkan fusi gen PML dan RAR, menjadi gen PML-RAR. Fusi gen PML-RAR
mengakbatkan blokade maturitas pada seri promielosit sehingga terjadi LPA. Kini
dikembangkan suatu obat yang disebut all-trans
retinoic acid (ATRA) yang menjadikan fusi gen PML-RAR sebagai target aksi
kerjanya. Pengobatan LPA dengan ATRA menghasilkan angka kesembuhan lebih dari
70%.
LPA merupakan
predisposisi untuk terjadinya koagulopati yang dalam hal ini diakibatkan oleh
kombinasi antara DIC dan hiperfibrinolisis primer. Pasien dengan manifestasi
koagulopati yang dalam hal ini diakibatkan oleh kombinasi antara DIC dan
hiperfibrinolisis primer. Pasien dengan manifestasi koagulopati harus segera
mendapat terapi induksi (ATRA). Pada pasien yang mengalami perdarahan yang
tidak terkendali (setelah terapi transfusi) dapat diberikan e-aminocaproic acid
(EACA) dan tranexamid acid.
Terapi induksi
LPA terdiri atas kombinasi ATRA plus kemoterapi berbasis antrasiklin.
Antrasiklin dapat menginduksi remisi pada 60-90% pasien bila digunakan sebagai
obat tunggal. Sel leukemik pasien LPA sensitif terhadap antarsiklin karena
rendahnya ekspresi Pgp dan petanda resistensi lainnya pada sel-sel LPA
dibanding dengan subtipe LMA lainnya. ATRA adalah suatu derivatif vitamin A
yang mampu menginduksi remisi klinis dengan mengaktifkan maturasi sel tanpa
menyebabkan hipoplasia sumsum tulang. Sebagai obat tunggal ATRA menginduksi
remisi pada 72-81% pasien. Umumnya ATRA mulai diberikan dalam 2-3 hari pertama
pada pasien dengan perdarahan berat untuk mengatasi koagulopati pada LPA
sebelum mulai dengan terapi berbasis antrasiklin. Cara ini akan menyebabkan
angka lekosit menjadi tidak terlalu tinggi lagi. Selain itu, cara ini
menurunkan insidens sindrom asam retinoid (retinoid
acid syndrome/RAS).
Terapi induksi
menggunakan ATRA 45mg/m2/hari per oral yang terbagi dalam 2 dosis setiap hari
sampai remisi komplit plus derivat antrasiklin, daunorubisin 50-60 mg/m2/hari
selama 3 hari atau idarubisin 12mg/m2/hari selama 4 hari. Terapi induksi
dilanjutkan dengan terapi konsolidasi dengan kemoterapi berbasis antarsiklin
dan terapi pemeliharaan dengan menggunakan ATRA.
RAS dapat
terjadi pada 10-15% pasien dan umumnya terjadi 7-14 hari setelah terapi ATRA.
RAS jarang terjadi selama penyembuhan akibat aplasia setelah kemoterapi dan
selama terapi pemeliharaan. RAS adalah suatu sindrom kebocoran kapiler dengan
manifestasi demam, distres respirasi, dan munculnya infiltrat pada paru. Dapat
juga terjadi peningkatan berat badan, efusi pleura atau efusi perikard, dan
gagal ginjal. Lekositosis berat merupakan faktor prognostik walaupun PAS sering
juga terjadi pada lekopenia. Bila angka lekosit lebih dari 5000-10000/uL, ATRA
dan kemoterapi diberikan bersama-sama pada saat awal terapi. Bila saat
monoterapi ATRA terjadi lekositosis lebih dari 10000/uL induksi kemoterapi
harus segera dimulai. Tanpa melihat angka lekosit dan kemungkinan sepsis
netropenia, bila terdapat sesak dan infiltrat paru, dengan atau tanpa demam,
terapi deksametason harus segera diberikan (10mg iv 2 kali sehari). Terapi ATRA
dapat dihentikan sampai RAS menunjukkan perbaikan.
Sekitar
20%-30% pasien LPA ang mencapai remisi komplit dengan terapi berbasis ATRA akan
mengalami relaps dan umumnya kelompok pasien ini juga resisten terhadap terapi
ATRA yang berikutnya. Arsenik, suatu racun yang sudah digunakan sebagai obat
pada pengobatan tradisional Cina sejak beberapa abat yang lalu, diketahui
mempunyai efek pengobatan yang positif pada pasien ATRA yang relaps atau
resisten terhadap terapi ATRA. Salah satu komponen arsen yang sering digunakan
di dalam klinik untuk terapi LPA yang relaps atau resisten terhadap ATRA adalah
arsenic trioxide (ATO). Sebagai terapi LPA, ATO mempunyai mekanisme kerja;
memacu degradasi fusi protein PML-RAR (khususnya protein PML, menginduksi
apoptosis, memacu diferensiasi sel-sel leukemik serta menghambat apoptosis. ATO
umumnya diberikan dengan dosis 0,15 mg per KG BB melalui infus 3 jam hingga
tercapai remisi komplit dengan maksimal pemberian 50 hari. Pada pasien LPA
relaps, terapi ATO menghasilkan respon sebesar 70% hingga 100%.
Prognosis
Dengan terapi agresif,
40 -50 % penderita yang mencapai remisi akan hidup lama (30-40 % angka
kesembuhan keseluruhan). Penderita yang mengalami relaps setelah mendapat
kemoterapi atau transplantasi autolog dapat diterapi dengan CST allogenetik
sebagai terapi penyelamatan. Beberapa subtipe morfologi atau genetik LMA
mempunyai prognosis lebih baik.
50-85% penderita LMA
memberikan respons yang baik terhadap pengobatan.
20-40% penderita tidak lagi menunjukkan tanda-tanda leukemia dalam waktu 5 tahun setelah pengobatan; angka ini meningkat menjadi 40-50% pada penderita yang menjalani pencangkokan sumsum tulang.
20-40% penderita tidak lagi menunjukkan tanda-tanda leukemia dalam waktu 5 tahun setelah pengobatan; angka ini meningkat menjadi 40-50% pada penderita yang menjalani pencangkokan sumsum tulang.
Prognosis yang paling
buruk ditemukan pada penderita yang berusia diatas 50 tahun, penderita yang
menjalani kemoterapi dan terapi penyinaran untuk penyakit lain. Pada golongan
M5 dan M6, semua pasien meninggal dunia sebelum 2 tahun, sedangkm M3 mempunyai
harapan hidup paling lama.
Daftar Pustaka/Referensi
- Bakta, I made. Hematologi Klinik Ringkas. Jakarta: EGC, 2006
- Behrman, Kliegman, Arvin. Nelson Ilmu Kesehatan Anak Ed. 15. Penerbit Buku Kedokteran EGC. 1996.
- Desen, Wan. Buku Ajar Onkologi Klinis Ed. 2. Balai penerbit Fakultas Kedokteran Universitas Indonesia : Jakarta. 2008
- Hoffbrand, A. V, J. E. Pettit, P.A.H Moss. Kapita Selekta Hematologi edisi 4.Jakarta: EGC, 2005
- Permono B, Ugrasena IDG. Leukemia Akut dalam Buku Ajar Hematologi-Onkologi Anak. Jakarta: Badan Penerbit Ikatan Dokter Anak Indonesia, 2005
- Sudoyo, Aru W., Bambang Setiyohadi, Idrus Alwi, Marcellus Simadibrata K, Siti Setiati. Buku Ajar Ilmu Penyakit Dalam Jilid II, Ed. IV. Departemen Ilmu Penyakit Dalam Fakultas Kedokteran Universitas Indonesia Jakarta, 2006.
- Supandiman, Iman. Prof. dr. DSPD. H. Hematologi Klinik Ed. 2. Penerbit Alumni : Bandung. 1997.
- Sylvia A. Price, Lorraine M. Wilson. Patofisiologi Konsep Klinis Proses-Proses Penyakit Ed. 6. Penerbit Buku Kedokteran EGC. 2003
- Kurniada A. Leukemia Mieloblastik Akut. Dalam: Sudoyo A., Setiyohadi B., Alwi I., (Ed.). Buku Ajar Ilmu Penyakit Dalam. Jilid II. Edisi IV. Balai Penerbit FKUI. Jakarta. 2006. Hal: 716-719.
- http://emedicine.medscape.com/article/197802-overview.
- Karen Seiter, MD, Professor, Department of Internal Medicine, Division of Oncology/Hematology, New York Medical College Contributor Information and Disclosures. Acute Myelogenous Leukemia. 2009
- Kapita Selekta Kedokteran. Edisi ketiga. Media Aesculapius: Fakultas Kedokteran UI. Hal: 561-562.
- http://www.medicastore.com. Leukemia Mieloid Akut. 2005.
- T Everington, R J Liesner, A H Goldstone. Acute Leucemia. Ed:Provan D. Clinical Haematology. Second edition. BMJ books. 2003. P:30-34
- Estey E., Faderl S., Kantarjian M. Hematologic Malignancies:Acute Leukemias. Springer Berlin Heiderberg. 2008. P:1-57.
- Beutler E., Marshall A., Lichtman M.. Williams Hematology 6th edition. November 2000. P:126-177.
- http://www.cumc.columbia.edu/dept/ps/2004/Academic/second_year/hematology/html/intro/ppframe.htm
Kata Kunci Pencarian : Leukemia Mieloblastik Akut, AML, Acute Myeloblastic Leukemia, Ilmu Penyakit Dalam, SKP (Satuan Kredit Profesi), Kompetensi, pdf, word, .pdf, .doc, .docx, Skripsi, Referat, Makalah, Jurnal, Tesis, Desertasi, Karya Tulis Ilmiah, Hematologi, Disertasi, Refrat, modul BBDM, Belajar Bertolak Dari Masalah, Problem Based Learning, askep (asuhan keperawatan)






0 comments:
Posting Komentar